薬物治療学講座
講座紹介
講義では、薬物治療を理解するための一連の科目を主に担当しています。薬物治療を適切に行うためには、まず体の変化を知ることが不可欠です。それには、正常な体の仕組みや働きを理解し(1年/機能形態学B)、様々な疾患の病態や診断に用いる臨床検査の知識(3年/病態検査学、臨床分析化学、生理薬理学実習)が必要です。これらがもととなり、様々な疾患に対する具体的な薬物治療(3年/薬物治療学B、4年/薬物治療学D)の知識に繋がります。
研究では、生化学的な手法、遺伝子解析法、遺伝子発現制御法などを駆使して、非アルコール性脂肪肝疾患の病態解明、抗がん剤の治療抵抗性改善、幹細胞の自己複製制御メカニズムに関する研究を行っています。
研究詳細
<非アルコール性脂肪肝疾患の病態解明>
DNAチップや次世代シークエンシング技術を用いて、ゲノムワイドな解析を行っています。遺伝子多型、遺伝子発現量、ゲノムのメチル化などについて、遺伝統計学やバイオインフォマティクスの技術を用いて、俯瞰的に病態を解明することを試みています。主にコンピュータを用いた計算が中心になります。実験結果と解析を組み合わせることにより、全体的な変化を明らかにして、病態解明、治療法の開発に繋げていきます(図1)。
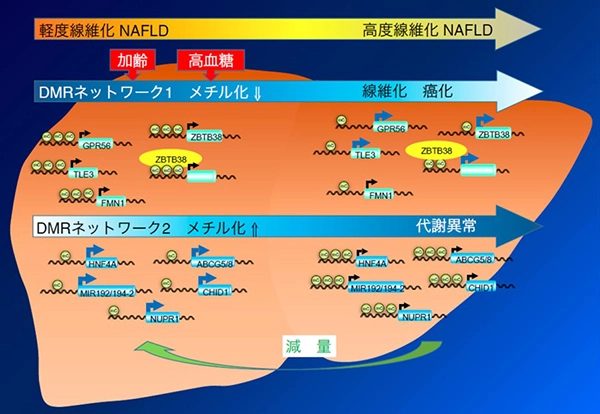
図1
<抗がん剤の治療効果および抵抗性に関する研究>
患者さんに応じた薬物治療を選択する個別化医療が、特にがん領域で進展しています。特定のタンパク質の発現量の違いや遺伝子変異の有無によって、抗がん剤の治療効果が異なることが知られています。本研究では、種々のがん由来の細胞株を用いて、抗がん剤の治療効果促進または治療抵抗性改善に関わるメカニズムを明らかにし、がん個別化治療に役立てることを目指しています。
<幹細胞の自己複製制御メカニズムに関する研究>
脳の神経は成人になっても再生することが近年わかってきました。実は脳にも神経を作る神経の幹細胞があります(図2)。再生医療の分野で重要な役割を担っている神経幹細胞の自己複製に、PARPという酵素が必須であることを明らかにしました。この酵素の阻害剤は、最近、抗がん剤として用いられ注目されています。本研究では、マウスから樹立した神経幹細胞を用いて、PARPが関わる自己複製制御機構をさらに詳細に解明し、再生医療やがん治療に役立てることを目指しています。
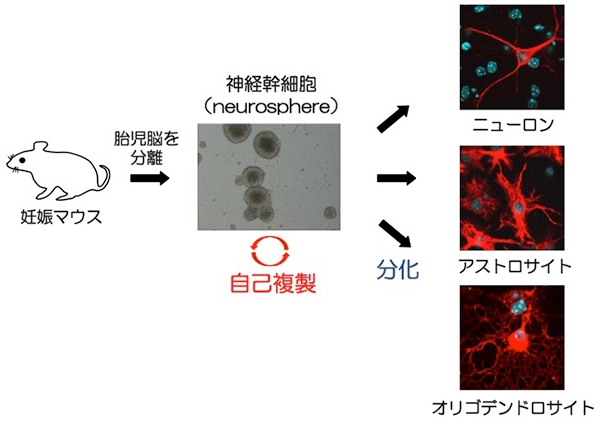
図2
主な研究業績
2024年度
- Kobori T., Ito Y., Urashima Y., Ito T., Takagaki N., Hotta K., Obata T. Ezrin works as a scaffold protein for a macrophage checkpoint molecule CD47, leading to a poor prognosis for patients with uterine cervical squamous cell carcinoma. Taiwanese Journal of Obstetrics and Gynecology, 64 (2): 239–247 (2025)
- 小堀 宅郎, 杉本 実希子, 伊藤 卓也, 堀田 紀久子. 神経膠芽腫患者における免疫チェックポイント分子 PD–L1 の発現と予後に対する細胞内足場タンパク質の関与. AYA がんの医療と支援, 4(2): 35–45 (2024)
- 小堀 宅郎, 伊藤 優衣, 田中 千都, 浦嶋 庸子, 山村 智代, 高垣 伸匡, 小畑 友紀雄. 膵臓癌患者の腹水における濾過濃縮再静注法前後のマクロファージ分極状態と免疫関連因子の動態変化. 在宅薬学, 11: 35–45 (2024)
2023年度
- Ito Y., Kobori T., Urashima Y., Ito T., Hotta K., Obata T. Moesin affects the plasma membrane expression and the immune checkpoint function of CD47 in human ovarian clear cell carcinoma. Journal of Reproductive Immunology, 161: 104185 (2024)
- Kurokawa S., Kobori T., Yoneda M., Ogawa Y., Honda Y., Kessoku T., Imajo K., Saito S., Nakajima A., Hotta K. Identification of differentially methylated regions (DMRs) associated with both liver fibrosis and hepatocellular carcinoma. BMC Gastroenterology, 24(1): 57 (2024)
- 小堀 宅郎, 伊藤 優衣, 浦嶋 庸子, 伊藤 卓也, 小畑 友紀雄. 日本人女性に多い卵巣明細胞腺癌における足場タンパク質を介した免疫チェックポイント分子 PD–L1 の発現調節. AYA がんの医療と支援, 4(1): 1–8 (2024)
- Kobori T., Ito Y., Doukuni R., Urashima Y., Ito T., Obata T. Radixin modulates the plasma membrane localization of CD47 in human uterine cervical adenocarcinoma cells. Journal of Reproductive Immunology, 158: 103982 (2023)
- Kobori T., Ito Y., Sawada Y., Urashima Y., Ito T., Obata T. Cellular membrane localization of innate immune checkpoint molecule CD47 is regulated by radixin in human pancreatic ductal adenocarcinoma cells. Biomedicine, 11: 1117 (2023)
- Urashima Y., Ueno T., Takeda C., Kusaba H., Tanaka R., Noda K., Kawakami K., Murakami T., Kawaguchi A., Suemitsu Y., Urashima K., Suzuki K., Kurachi K., Nishihara M., Neo M., Myotoku M., Kobori T., Obata T. Study on enteral nutrient components causing decreased gastric phenytoin absorption. Journal of Parenteral and Enteral Nutrition, 47(7): 911–919 (2023)
- Amadutsumi T., Urashima Y., Urashima K., Suzuki K., Kurachi K., Nishihara M., Neo M., Myotoku M., Kobori T., Obata T. Semisolid enteral nutrients alter the pharmacokinetics of orally administered levetiracetam in rats. Pharmazie, 78(8): 117–121 (2023)
- 【JA】コンドロイチン硫酸生合成を阻害するアンチセンス核酸
【EN】ANTISENSE NUCLEIC ACID CAPABLE OF INHIBITING BIOSYNTHESIS OF CHONDROITIN SULFATE
武内 恒成、笹倉 寛之、鈴木 高尾、山上 正輝、川野邊 峻哲、セレスタ アジャヤラム、宮阪 由依、梅本 忠士、関口 和生、小堀 宅郎. WO/2023/176920
2019年度
- Sato S, Morimoto T, Hotta K, Fujikado T, Nishida K: Eleven-year follow-up of a Japanese retinitis pigmentosa patient with an HK1 gene mutation. Ophthalmic Genet. 40(5):466-469 (2019)
- Okuda A, Tahara S, Hirose H, Takeuchi T, Nakase I, Ono A, Takehashi M, Tanaka S, Futaki S: An Oligoarginine-Bearing Tandem Repeat Penetration-Accelerating Sequence Delivers Protein to the Cytosol via Caveolae-Mediated Endocytosis. Biomacromolecules, 20(5):1849-1859 (2019)
- Kurokawa S, Okuda A, Kondo Y, Tanaka S, Takehashi M: Identification of transcriptional regulatory elements of the poly(ADP-ribose) polymerase-1 gene in neural stem/progenitor cells. Int J Anal Bio-Sci, 7(1):6-13 (2019)
- Kurokawa S, Okuda A, Nishizawa Y, Furukawa K, Sumihiro A, Nakaji Y, Tanaka S, Takehashi M: Suppression of cell cycle progression by poly(ADP-ribose) polymerase inhibitor PJ34 in neural stem/progenitor cells. Biochem Biophys Res Commun, 510(1):59-64 (2019)
2018年度
- 黒川優、奥田明子、竹橋正則、田中静吾:ポリ(ADP-リボース)合成酵素阻害剤PJ34の神経幹細胞の細胞周期抑制作用について、第41回日本分子生物学会年会(横浜、2018年11月28-30日、2018年度)
2017年度
- Okuda A, Kurokawa S, Takehashi M, Maeda A, Fukuda K, Kubo Y, Nogusa H, Takatani-Nakase T, Okuda S, Ueda K, Tanaka S: Poly(ADP-ribose) polymerase inhibitors activate the p53 signaling pathway in neural stem/progenitor cells. BMC Neurosci, 18(1):14 (2017)
2016年度
- Kurokawa S, Tanaka S, Takehashi M: Tissue-specific transport mechanism of selenium [Jpn]. J Anal Bio-Sci (Seibutu Shiryo Bunseki). 39(4):217-25 (2016)