薬物動態学講座
講座紹介
投与された薬は、体内で吸収 Absorption され、組織に分布 Distribution し、代謝 Metabolism され、排泄 Excretion されるという運命をたどります。これらの過程を英語の頭文字をとってADME(アドメ)とよびます。生体内での薬の挙動(濃度変化)を解析するのが薬物動態研究です。薬は生体にとって異物であり、病気を治す主作用と、体にとって危険な副作用(有害作用)をあわせもつため、いかに優れた薬でも使用方法や服用量をあやまると「毒」となりえます。本講座では、薬の副作用を防いで十分な効き目が得られる方法論を導くために、ADMEの中で薬の生体内挙動に大きく影響を与える、薬の代謝過程Drug Metabolismの研究を主に行っています。この研究は、さまざまな状況で薬を単独あるいは併用した場合に、薬の濃度が変化して、薬効が減弱あるいは増強、または副作用が発生するような患者の不利益をなくすことにつながります。
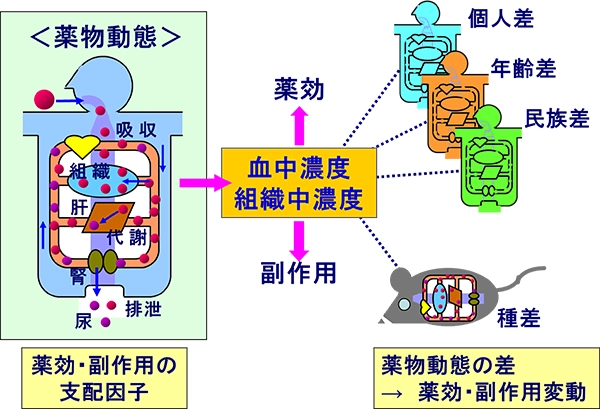
図1 薬物の体内動態と薬効・副作用とのかかわり
スタッフ
- 教授
- 橋爪 孝典
研究詳細
【研究テーマ1】
シトクロムP450(P450)は、一般に医薬品などの外来性異物の代謝を行う薬物代謝型P450と、ステロイドホルモン、脂肪酸、エイコサノイドおよびビタミン等の内因性物質の生合成や分解に関与するP450に大別されます。後者は組織特異的な生理機能を発揮する生理活性物質の制御に重要な役割を果たしています。心臓、肺、小腸、腎臓などに存在するCYP2J2は生理活性物質アラキドン酸のエポキシゲナーゼとして知られ、心疾患との関連性が古くから示されているP450分子種の一つです。一方、我々はCYP2J2がヒト小腸や肝臓において抗ヒスタミン薬エバスチンの初回通過効果に大きく関与し、薬物代謝型酵素としての機能を併せもつP450であることを明らかにしました (J. Pharm. Exp. Ther. 300, 2002)。その後、アステミゾール、テルフェナジンなどの抗ヒスタミン薬をはじめアミオダロン、アピキサバンおよびダナゾールもCYP2J2によって代謝されることが報告され、薬物代謝型酵素として役割が注目されています。さらに最近では、CYP2J2ががん細胞で高発現しており、アラキドン酸の代謝産物が細胞増殖と深く関連していることが報告され、CYP2J2は心疾患だけでなく悪性腫瘍の創薬ターゲットとしても注目されています。本講座では、CYP2J2、CYP4F2およびCYP4F12など、未知の部分が多いCYP分子種についての研究を進めています。
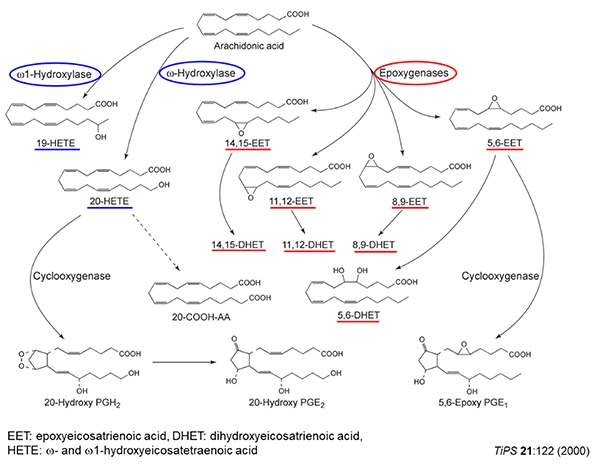
図2 アラキドン酸の代謝経路
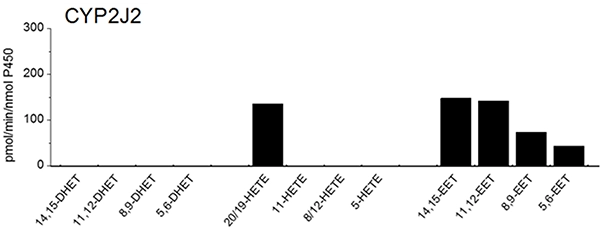
図3 ヒトCYP2J2によるアラキドン酸の代謝
【研究テーマ2】
パーキンソン病 (Parkinson’s disease: PD) は、黒質線条体系のドパミン神経細胞の脱落とαシヌクレイン陽性のレビー小体を主要病理とする神経変性疾患です。また、その病理の進行に神経炎症が関与していることや、PDは錐体外路症状が主体であるが病初期より前頭葉機能障害を呈することが知られています。
我々は岐阜薬科大学や関西医科大学と共同で、細胞や実験動物を用いた in vitro 及び in vivo実験においてゾニサミドにはドパミン遊離作用だけでなく、神経保護作用も有することを明らかにしてきました1,2)。しかしながら、ヒト生体脳におけるゾニサミドの神経保護作用の長期効果については不明でありました。そこで浜松医科大学との共同研究により、Positron Emission Tomography (PET)を用いてヒト生体脳での神経保護作用の長期効果や薬物濃度との関係などを調べています3)。
-
Zonisamide suppresses endoplasmic reticulum stress-induced neuronal cell damage in vitro and in vivo. Eur J Pharmacol. 746, 301-307 (2015).
-
Zonisamide ameliorates levodopa-induced dyskinesia and reduces expression of striatal genes in Parkinson model rats. Neurosci Res.122, 45-50 (2017).
-
Extrastriatal spreading of microglial activation in Parkinson's disease: a positron emission tomography study. Ann Nucl Med. 30, 579-587 (2016).
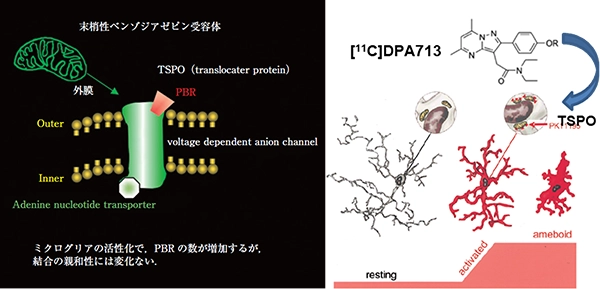
図4 ミクログリアの活性化とトランスロケータタンパク質 (18 kDa)
[11C]DPA713は、活性化したミクログリアをイメージングするためのTSPOに対するPETトレーサーです。
脳内神経炎症に関与するミクログリアが活性化すると、トランスロケータタンパク質 (18 kDa)(TSPO:末梢型ベンゾジアゼピン受容体ともよばれる)が増加することが知られています。そこでTSPOに対するPETトレーサーである[11C]DPA713を用いて、活性化ミクログリア(神経炎症)のイメージングを行っています。また、もう一つのPETトレーサー [11C]CFTは、ドパミントランスポーターに結合し、ドパミン節前細胞の機能を反映するトレーサーで、これら2つのトレーサーを駆使して、早期PD患者におけるゾニサミド投与5年後の神経炎症とドパミン節前細胞脱落を調べ、ゾニサミドの神経保護効果について研究を行っています。
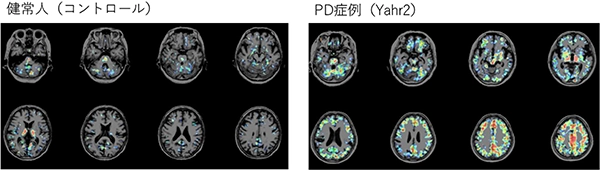
図5 [11C]DPA713 PET結合能の画像
早期PD患者(右)では、皮質全体にミクログリアが活性化していることがわかります。
【研究テーマ3】
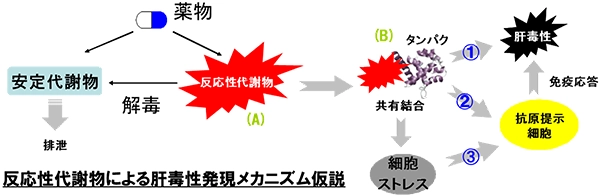
医薬品の開発は膨大な費用と長い年月を必要とします。しかしながら、開発後期の臨床試験や市販後において、予期せぬ副作用や毒性発現による試験中止や販売中止が後を絶ちません。中止原因の上位に位置するのが肝障害で、なかでも特異体質性肝障害(idiosyncratic drug hepatotoxicity)と呼ばれる肝障害は発生頻度が非常に稀で、動物実験や臨床試験で見つけることができません。多くの研究者がこの種の副作用のメカニズムを研究し、発症を予測し回避する手段を模索していますが、発症メカニズムの全容は明らかとなっていません。しかしながら、薬物代謝酵素による反応性代謝物(化学的に反応性の高い代謝物)の生成が引き金の一つと考えられています。そこで製薬企業ではグルタチオンを用いたトラッピング試験や放射性同位体を用いた共有結合試験が行われ、医薬品の候補化合物のRMの生成能を検出し、リスク低減の取り組みが行われています。本講座では、これまで行ってきた手法 (Drug Metab Dispos 37 2009, Drug Metab Dispos 39 2011)に代わる新生タンパク質のジスルフィド変換反応を触媒する酵素Protein Disulfide Isomeraseに着目し、新たなRMを検出するスクリーニング系を開発しています。
主な研究業績
2024年度
-
Terada T, Bunai T, Hashizume T, Matsudaira T, Yokokura M, Takashima H, Konishi T, Obi T, Ouchi Y. Neuroinflammation following anti-parkinsonian drugs in early Parkinson's disease: a longitudinal PET study. Sci Rep. 14(1), 4708 (2024).
2021年度
-
Magata T, Hirokawa Y, Rokuhara Y, Nakayama R, Takahashi R, Nogami M, Tai Y, Imahori T, Hashizume T, and Maezaki N: Synthesis and Evaluation of Dendroamide A and Three Regioisomeric Analogs Having a Reversed Azole Ring as P-Glycoprotein Inhibitors, Heterocycles 102(5), 900-919 (2021).